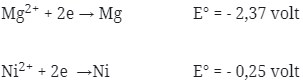
Potensial yang dihasilkan oleh reaksi Mg + NiCl2 → MgCl2 + Ni adalah …
a. -2,12 volt
b. +2,12 volt
c. +1,06 volt
d. -2,62 volt
e. +0,80 volt
Jawaban : B
Pembahasan :
Perhatikan E° nya ! logam yang memiliki E° lebih kecil selalu merupakan anode (mengalami oksidasi). Sudah pasti bahwa Mg adalah anode (mengalami oksidasi) dan Ni adalah Katode (mengalami reduksi).
Pada soal reaksi tidak berbentuk ion, berarti NiCl2 dan MgCl2 dipecah lagi sehingga menghasilkan ion.
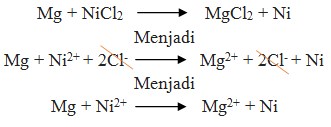
E°sel = E°katode – E°anode
= – 0,25 – (- 2,37 )
= + 2,12 volt
2. Diketahui :
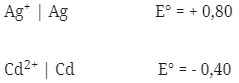
Potensial sel yang dihasilkan dari pasangan elektrode Cd dengan Ag adalah …
a. 0,40 V
b. 0,44 V
c. 0,76 V
d. 0,80 V
e. 1,20 V
Jawaban : E
Pembahasan :
Logam yang memiliki E° lebih kecil selalu merupakan anode (mengalami oksidasi) berarti yang sebagai anode Cd dan sebagai katode Ag.
Notasi Selnya :
Cd|Cd2+||Ag+|Ag
E°sel = E°katode – E°anode
= + 0,80 – (-0,40)
= 1,20 V
CHAPTER 20
1.Unsur-unsur logam alkali dengan urutan Li, Na, K, Rb, dan Cs yang tidak memiliki sifat-sifat seperti tercantum berikut adalah…
a. Jari-jari atom makin besar
b. Energi ionisasi makin besar
c. Massa jenis makin besar
d. Nomor atom makin besar
e. Titik lebur makin kecil
Pembahasan
Sifat-sifat unsur alkali :
- Nomor atom dari atas kebawah semakin besar
- Titik leleh dari atas kebawah semakin kecil
- Titik lebur dari atas kebawah makin kecil
- Jari-jari atom dari atas kebawah makin besar
- Energi ionisasi dari atas kebawah semakin kecil
- Massa jenis dari atas kebawah makin besar
Jawaban : B
2.Unsur logam alkali yang memberikan warna nyala berwarna merah adalah….
a. Natrium
b. litium
c. kalium
d. sesium
e. Barium
Pembahasan
Jika logam alkali dibakar, akan menghasilkan warna nyala yang khas. Seperti, logam litium (Li) berwarna merah, natrium (Na) berwarna kuning, kalium (K) berwarna ungu muda, rubidium (Rb) berwarna ungu dan sesium (Cs) berwarna biru
Jawaban : B
CHAPTER 21
1.Urutan kekuatan asam halida….
a. HF>HCl>HBr>HI
b. HF>HBr>HCl>HI
c. HF>HI>HBr>HCl
d. HI>HBr>HCl>HF
e. HI>HF>HCl>HBr
Jawaban : D
Pembahasan :
Asam halide terdiri atas flourida (HF), asam klorida (HCl), asam bromide (HBr) dan asam iodide (HI). Kekuatan asam tersebut bergantung pada kekuatan ikatan antara H dan X atau kemudahan senyawa halide untuk memutuskan ikatan antara H dan X.
Semakin keatas dalam golongan VIIA, ikatan antara atom H dan X semakin kuat sehingga molekuk HX yang terbentuk cukup stabil. Oleh karena itu, hanya sedikit molekul HX yang terurai menjadi H+ dan X–. Jadi, HF merupakan asam halide yang terlemah karena ikatannya paling kuat
Sebaliknya, semakin ke bawah dalam golongan VIIA, ikatan antara atom H dan X semakin lemah. Akibatnya, ikatan itu semakin mudah putus dan semakin mudah menghasilkan ion H+. Jadi, senyawa HI merupakan asam halide yang terkuat karena ikatannya paling lemah. Dengan demikian, urutan kekuatan asam halide sebagi berikut: HI>HBr>HCl>HF.
HF termasuk asam lemah dan memiliki harga Ka = 6,8 x 10-4. Adapun HCl, HBr, dan HI tergolong asam kuat.
2.Di antara pernyataan di bawah ini yang bukan sifat halogen adalah….
a. Pada suhu kamar, F2 dan Cl2 berwujud gas
b. Unsur halogen merupakan pengoksidasi kuat
c. Unsur halogen selalu terdapat dalam bentuk monoatomik
d. Pada suhu kamar, Br2 berwujud cair
e. Iodin mempunyai titik didih tertinggi diantara unsur halogen lainnya.
Jawaban : C
Pembahasan
Pada suhu kamar, F dan Cl itu berwujud gas pada suhu ruangan, Br berwujud cair dan I dan At berwujud padat. Atom unsur halogen sangat mudah menerima electron dan membentuk ion negative. Karena kemudahannnya membentuk ion negative, halogen digolongkan ke dalam pengoksidasi kuat.
Unsur halogen berada sebagai molekul diatomic yang karena bersifat nonpolar terikat satu sama lain dengan gaya London. Gaya London pada halogen bekerja pada molekul-molekul diatomic dengan jumlah atom dan bentuk molekul yang sama.
CHAPTER 22
1. Unsur transisi yang bersifat feromagnetik adalah …
a. Sc
b. Ti
c. Cr
d. V
e. Co
Jawaban : E
Pembahasan :
Feromagnetik (Fero : besi : besi itu kuat) = Sifat magnet yang ditarik kuat ke medan magnet. Syaratnya adalah semakin banyaknya elektron tidak berpasangan atau lebih dari satu. Contohnya, Fe, Co, dan Ni.
Sifat Feromagnetik → Sifat ini dimiliki zat yang mempunyai atom-atom paramagnetik yang berada pada jarak sedemikian sehingga interaksi yang terjadi antara atom-atom begitu kuat.
2.Pernyataan berikut yang bukan merupakan sifat unsur transisi adalah …
a. Bersifat nonlogam
b. Mempunyai beberapa bilangan oksidasi
c. Bersifat paramagnetik
d. Dapat membentuk senyawa kompleks
e. Senyawanya berwarna
Jawaban : A
Pembahasan :
Unsur transisi mempunyai siat-sifat khas yang membedakan dari unsure golongan utama, antara lain :
- Sifat logam, semua unsure transisi tergolong logam dengan titk cair dan titik didih yang relatif tinggi.
- Bersifat paramegnetik (sedikit tertarik ke dalam medan magnet).
- Membentuk senyawa-senyawa yang berwarna.
- Mempunyai beberapa tingkat oksidasi.
- Membentuk berbagai macam ion kompleks.
- Berdaya katalitik, banyak unsur transisi atau senyawanya yang berfungsi sebagai katalis, baik dalam proses industri maupun dalam metabolisme.
1.Partikel terberat yang dipancarkan oleh unsur radioaktif adalah….
a. Sinar α
b. Sinar β
c. Sinar X
d. Positron
e. Sinar γ
Pembahasan
Partikel terberat yang dipancarkan oleh unsur radioaktif adalah sinar γ, dimana sinar alfa dihasilkan oleh inti-inti atom berat (Z > 83) yang hal ini menyebabkan nomor atom berkurang dua, sedangkan nomor massa berkurang empat.
Jawaban: E
2.Bila suatu unnsur radioaktif Z sesudah 42 bulan masih tersisa 1/64 bagian dari berat semula, maka dapat dinyatakan bahwa waktu paro unsur Z adalah….
a. 10 bulan
b. 8 bulan
c. 7 bulan
d. 6 bulan
e. 5 bulan
Pembahasan :
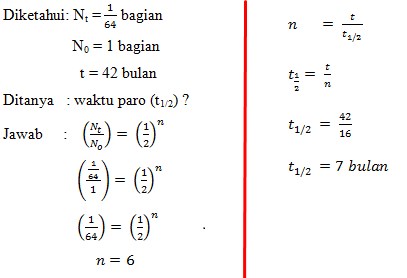
Jawaban: C
CHAPTER 24
1.Nama IUPAC dari senyawa berikut
![]()
adalah….
A. metana
B. etana
C. propana
D. butana
E. pentana
Pembahasan:
Semua ikatan adalah ikatan jenuh (rangkap satu maka nama senyawa dalam homoolog alkana (berakhiran ana),
Jumlah C sebanyak 5 dalam keadaan rantai lurus maka nama yang tepat adalah pentana
Jawaban: E
2.Yang merupakan struktur dari 2-butena adalah….
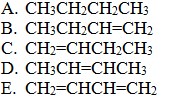
Pembahasan:
2-butena berarti ada atom C sebanyak 4, terdapat ikatan rangkap dua (ena) pada C ke 2
CH3CH=CHCH3
CHAPTER 25
1.Protein adalah suatu makromolekul yang komponen utamanya adalah ….
a. Lipid
b. Hidrokarbon
c. Karbohidrat
d. Asam Amino
e. Asam Nukleat
Jawaban : D
Pembahasan :
Protein adalah senyawa terpenting penyusun sel hidup. Senyawa ini terdapat dalam semua jaringan hidup baik tumbuhan maupun hewan. Molekul protein memiliki massa molekul relatif sangat besar karena merupakan polimer dari molekul sederhana.
Jika protein dididihkan dengan asam kuat atau basa kuat yang pekat, molekkulnnya akan terhidrolisis menjadi asam amino. Molekul protein disusun oleh pengulangan satuan (unit) molekul sederhana, yaitu asam amino.
2.Polimer yang merupakan karet sintesis pada pembuatan ban mobil adalah ….
a. Polistirena
b. Polipropena
c. Polibutadiena
d. Polietilena
e. Politetraflouroetilena
Jawaban : C
Pembahasan :
Karet sintetis ada beberapa macam, diantaranya polibutadiena, polikloroprena, dan SBR (Styrena-Butadiene Rubber)
- Polistirena dikembangkan dalam bentuk plastik busa pada pembuatan pembungkus makanan
- Polipropena digunakan untuk membuat botol plastik, karung, bak air, tali dan kabel listrik (insulator)
- Polietilena adalah plastik yang banyak diproduksi, dicetak lembaran untuk kantung plastik, pembungkus makanan, ember, dan sebagainya
- Politetraflouroetilena (Teflon) merupakan lapisan tipis yang sangat tahan panas dan tahan terhadap bahan kimia. Digunakan sebagai pelapis wajan



Tidak ada komentar:
Posting Komentar