Contoh soal 1
Hitunglah volume pelarut yang harus ditambahkan jika 100 mL larutan KOH 0,1 M diencerkan sehingga konsentrasinya menjadi 0,01 M ?
a.100 mL
b1200mL
c.1000mL
d.1300mL
e.2000mL
Jawaban: c.1000mL
Pembahasan:
V1 = 100 mL
M1 = 0,1 M
M2 = 0,01 M
V1 . M1 = V2 . M2
100 . 0,1 = V2 . 0,01
10 = 0,01V2
V2 = 100,01
= 1000 mL
Jadi volume pelarut yang harus ditambahkan adalah 1000 mL
Contoh soal 2
Sebanyak 275 ml larutan H2SO4 0,75 M ditambahkan air sebanyak 525 mL. Hitunglah konsentrasi larutan setelah penambahan air ?
a.0.285 M
b.0,185 M
c.1 M
d.0,280 M
e.0,1 M
Pembahasan
V1 = 275 mL
M1 = 0,75 M
V2 = 525 mL + 275 mL = 800 mL
V1 . M1 = V2 . M2
275 . 0,75 = 800 . M2
206,25 = 800M2
M2 = 206,250,01
= 0,285 M
Jadi konsentrasi larutan setelah penambahan air adalah 0,285 M ir ?
Contoh soal 3NAOH ( Mr = 40 ) sebanyak 6 gram dilarutkan kedalam air sehingga volumenya menjadi 150 mL. Hitunglah kemolaran larutan tersebut ?
a. 1,11 mol/L
b.1 mol/L
c 1.1 mol/L
d.2 mol/L
e.0,5 mol/L
Jawaban : b.1 mol/L
Mr = 40
m = 6 gram
V = 150 mL = 0,15 L
M = mMr
x 1000V
M = 640
x 1000150
= 1 mol/L
Contoh soal:
Suatu sampel mengandugn senyawa besi karbonat (FeCO3) dan senyawa inert dilarutkan ke dalam akuades. Larutan kemudian dioksidasi dengan pereaksi sehingga besi terendapkan. Endapan kemudian disaring dan dibakar sehingga didapatkan senyawa besi (III) oksida (Fe2O3) sebanyak 1,0 g. Berapakah kandungan besi karbonat dalam sampel?
a.1,47 gr
b.1,46 gr
c.0,146 gr
d.1 gr
e.2,1 gr
jawaban : b.1,46 gr
Massa besi karbonat dalam sampel adalah,
Massa FeCO3 = massa Fe2O3 x 2 x Ar Fe x Mr FeCO3
Mr Fe2O3 1 x Ar Fe
= 1,0 g Fe2O3 x 2 x 56 g Fe x 116 g FeCO3
160 g Fe2O3 1 x 56 g Fe
= 1,45 g FeCO3
Jadi kadungan besi karbonat dalam sampel awal adalah 1,45 g.
Contoh soal 2.
Berapakah massa Fe3O4 murni yang dibutuhkan untuk dioalah agar didapatkan besi (III) oksida, Fe2O3, sebanyak 0,6 g ?
a.0,58 gr
b.0,058 gr
c5,8 gr
d.2 gr
e 5,9 gr
Jawaban : a.0,58 gr
Reaksi yang terjadi dalam hal ini adalah
2 Fe3O4 + ½ O2 → 3 Fe2O3
Reaksi di atas menunjukkan bahwa untuk setiap 2 mol Fe3O4 akan menghasilkan 3 mol Fe2O3, dengan demikian massa Fe3O4 murni yang dibutuhkan adalah :
= 0,60 g Fe2O3 x 1 mol Fe2O3 x 2 mol Fe3O4 x 232 g Fe3O4
160 g Fe2O3 3 mol Fe2O3 1 mol Fe3O4
= 0,58 g Fe3O4
Jadi dibutuhkan senyawa Fe3O4 sebanyak 0,58 g.
Contoh soal 3
Sebanyak 3.46 g sampel batu kapur (CaCO3) dilarutkan dalam larutan HCl 0.1 M. Lalu, larutan ammonium oksalat 0.1 M berlebih ditambahkan ke dalam larutan kapur menghasilkan endapan kalsium oksalat. Endapan tersebut dipisahkan, dikeringkan, dan ditimbang. Didapatkan 2.03 g kalsium oksalat. berapa persen massa kalsium dalam sampel batu kapur tersebut.?
a.19,22%
b.18,32%
c.18,22%
d.19,32%
e.12,325
Jawaban:b.18,32%
Reaksi:
CaCO3 + 2 HCl CaCl2 + H2O + CO2
CaCl2 + (NH4)2C2O4 CaC2O4 + 2 NH4Cl
Persen massa Ca = 0.634 𝑔𝑔3.46 𝑔𝑔×100%=18.32%
4.7 Titrasi asam basa(kembali)
Contoh Soal 1
Berapa konsentrasi dari larutan asam asetat CH3COOH jika diketahui untuk titrasi 25 mL larutan CH3COOH tersebut diperlukan 15 mL larutan NaOH 0,05 M agar mencapai titik ekivalen?
a.0,03 M
b 3 M
c.0,06 M
d 0,6 M
e 0,3 M
Jawaban : a.0,03 M
Persamaan reaksi netralisasi CH3COOH dengan NaOH:
CH3COOH(aq) + NaOH(aq) → CH3COONa(aq) + H2O(l)
Dari persamaan reaksi, diperoleh: 1 mol CH3COOH 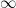 1 mol NaOH
1 mol NaOH
sehingga bisa dapat:
Contoh Soal 2
Sebanyak 40 mL larutan asam sulfat 0,25 M dititrasi dengan suatu basa bervalensi satu, dan ternyata dibutuhkan 57 mL basa tersebut. Berapakah kemolaran basa yang digunakan tersebut?
a.0,45 M
b0,35 M
c.2 M
d.0,33 M
e.0,37 M
Jawab:
Reaksi netralisasi terjadi antara asam sulfat H2SO4 (asam kuat bervalensi dua) dengan suatu basa bervalensi satu
Contoh soal 3
Berikut data hasil titrasi larutan HCL dengan larutan NaOH 0,1 M
Berdasarkan data tersebut,konsentrasi larutan HCL adalah
a.0,070 M
b0,075 M
c.0,080 M
d 0,133 M
e.0,143 M
Jawaban : b.0.075 M
Contoh 1
bepakah N Na2S2O3 jika diketahui mol Cr2O72- dan 2I- masing-nasing sebesar 0,00208 dan 0,15 ?
a.0,106 N
b.0,206 N
c.0,110 N
d.0,116 N
e.0,216 N
Jawaban : a. 0,106 N
contoh 2
berdasarkan reaksi di atas berapakah kadar kafein tersebut?
a0,07224 (b/b)
b.0,08224 (b/b)
c.0,09233 (b/b)
d.0,07345 (b/b)
e.0,1 (b/b)
Jawaban : a 0,07224 (b/b)
setelah itu,baru kita cari kadar kafein
1 mol NaOH










Tidak ada komentar:
Posting Komentar