Buat lah 2 soal (per chapter) pilihan ganda dari kelompok lain(1s/d 12(selain chapter anda)
Chapter 1
1. Suatu jenis material X berbentuk kubus dengan sisi 4 m. Material tersebut ditimbang dengan neraca sebesar 2 Kg. Berapakah masa jenis atau densitas masa benda X ?
a .0,125 Kg/m^3
b.125 Kg/m^3
c.0,345 Kg/m^3
d.0.45 Kg/m^3
e.0,457 Kg/m^3
Jawaban : a
penjelasan :
Diketahui massa = 2 Kg dan volume berbentuk kubus = 43 =16
Sehingga densitas masa dari material tersebut adalah ρ = 2/16 = 0.125 Kg/m^3
2. Sebuah besi dengan bentuk tak beraturan ditimbang memilki berat 14 Kg. Besi tersebut akan diukur volumenya dengan gelas ukur berisi air. Sebelum dimasukan besi, volume air memenuhi gelas ukur. Setelah dimasukkan sebuah besi, air di gelas tumpah. Berapakah volume air yang tumpah ?
a.177 m^3
b.711m^3
c.1,77 m^3
d.1,75 m^3
e.1.78m^3
Jawaban : c
Penjelasan :
Massa batu (m) = 14 Kg
massa jenis ρ besi = 7,874 Kg/ m³
Volume batu yang dimasukkan ke dalam gelas ukur berisi air membuat air di gelas tumpah terbuang. Artinya Volume air tumpah = Volume Batu
v = m / ρ = 14 / 7,874 = 1,77 m³.
jadi air yang terbuang adalah 1,77 m³.
Chapter 2
3.Jika Z natrium adalah 11. Temukan jumlah elektron dan jumlah proton yang ada dalam atom natrium.?
a.11
b.13
c.14
d.12
e.15
Jawaban : a
penjelasan :
Kita tahu bahwa “Z = Jumlah Proton = Jumlah Elektron“
Dengan demikian, Jumlah elektron = 11 dan Jumlah proton = 11Jumlah proton = 8
Jumlah elektron =8
Jumlah neutro = 17 – 8 = 9
Chapter 3
5.Dari hasil analisis unsur pada senyawa pirimidin, diperoleh kadar unsur karbon 60%, hidrogen 5%, dan sisanya nitrogen. Tentukanlah rumus empiris senyawa primidin?
a.C2H2N
b.C3H3N2
c,C2H4N2
d,CHN
e.C6H7N8
Jawaban : a
Penjelasan:
Ar Fe =
7.Volume oksigen (O2) 5 liter bertekanan 2 x 105Pa memiliki massa 16 gram. Jika R = 8,31 J/mol.K, berapakah suhu helium tersebut?( x 10^2K)
Diketahui:
m = 16 gram
Mr O2= Ar O x 2 = 32
P = 2 x 105Pa
R = 8,31 J/mol.K
V = 5 liter = 5 x 10-3 m3
Ditanya: T … ?
Jawab:
n = M/Mr = 16/32
sehingga
P . V = n . R . T
T = P.V/n.R
T = (2 x 105)(5x 10-3)/(0,5)(8,31)
T = 2,406 x 102K
O=O = 499 kJ/mol dan H-O = 460 kJ/mol, maka entalpi reaksi pembentukan H2O2 adalah
A. –127
B. –209
C. –484
D. –841
E. +127
H–H + O=O → H–O–O–H
| H–H | + | O=O | → | H–O–O–H | |
| +436 | +499 | +460+142+460 | |||
| +935 | – | +1062 | = –127 kJ | ||
Jawaban :c
Terdapat dua aturan mengenai konfigurasi elektron untuk unsur krom yaitu aturan Aurbau dan menurut percobaan setengah penuh atau penuh. Berikut konfigurasi keduanya:
Menurut aturan Aufbau untuk Cr adalah 1s2 2s2 2p6 3s2 3p6 4s2 3d4. Berdasarkan percobaan
1s2 2s2 2p6 3s2 3p6 4s1 3d5 (setengah Penuh). Sub kulit d, terisi elektron setengah penuh atau penuh ternyata lebih stabil dibandingkan dengan aturan aufbau.
12.Berapakah jumlah elektron tidak berpasangan dalam ion Ag+?
- 1
- 2
- 3
- 4
- 0
Konfigurasi elektron Ag
= 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s1 4d10
Konfigurasi elektron Ag+
= 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 4d10
Karena orbital semua telah terisi penuh maka tidak ada elektron yang tidak berpasangan, semua elektron berpasangan
chapter 8
13.Energi ionisasi pertama, kedua, dan ketiga untuk unsur Na (dalam kJ/mol) adalah ....
(A) 496, 4.560, dan 6.900(B) 578, 1.820, dan 2.750
(C) 736, 1.450, dan 7.730
(D) 786, 1.580, dan 3.230
(E) 1.012, 1.904, dan 2.190
Na merupakan unsur yang terletak pada golongan 1A dengan konfigurasi elektron 1s2 2s2 2p6 3s1 (2-8-1). Stabil ketika ia melepaskan elektron pertama (membentuk Na+) konfigurasi elektron Na 2-8.
Bila suatu spesi stabil (biasa elektron valensinya 8 seperti pada Na+) maka diperlukan energi yang besar untuk melepaskan lagi elektron yang dimiliki. Ini ditandai dengan energi ionisasi yang melonjak sangat besar dari sebelumnya.
(B) 578, 1.820, 2.750, 11.600
(C) 738, 1.450, 7.730, 10.500
(D) 786, 1.580, 3.230, 4.360
(E) 1.022, 1.904, 2.910, 4.960
Karena Al stabil setelah melepaskan 3 elektron (ditandai dengan muatan 3+ saat membentuk senyawa) maka untuk melepaskan elektron keempat energi ionisasinya menjadi sangat besar, melonjak, naik drastis, dari energi ionisasi ketiga ke energi ionisasi keempat.
| Ikatan | Energi Ikatan kJ mol–1 |
| C=C | 609 |
| C–H | 412 |
| C–C | 345 |
| H–Cl | 426 |
Jika entalpi reaksi : CH2 =CH2(g) + HCl (g) → CH3CH2Cl(g)
adalah –48 kJ mol–1 , energi ikatan rata-rata C–Cl adalah ....
(A) 278 kJ mol–1
(B) 326 kJ mol–1
(C) 756 kJ mol–1
(D) 824 kJ mol–1
(E) 1648 kJ mol–1
| Ikatan | Energi Ikatan (kJ mol–1 ) |
| C–H | 410 |
| C–Cl | 330 |
| Cl–Cl | 243 |
| H–Cl | 432 |
C2H6(g) + Cl2(g) → C2H5Cl(g) + HCl(g)
Nilai entalpi reaksi di atas adalah ....
(A) +218 kJ mol–1
(B) –218 kJ mol–1
(C) +109 kJ mol–1
(D) –109 kJ mol–1
(E) +89 kJ mol–1
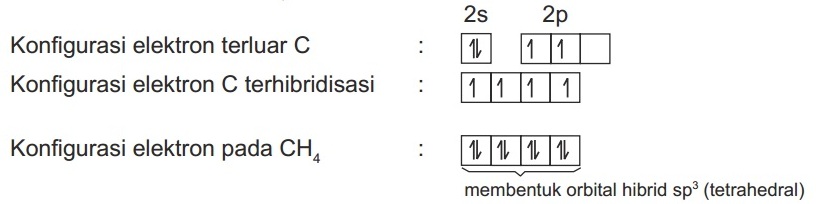
A. sp
B. sp3
C. sp3d2
D. sp2
E. sp3d
Jawaban : b
penyelesaian:
Konfigurasi elektron atom 6C = 1s2 2s2 sp2
Empat elektron yang tidak berpasangan pada konfigurasi elektron C terhibridisasi akan berpasangan dengan elektron dari atom H sehingga membentuk orbital hibrid sp3 (tetrahedral).
- AsH3
- BCl3
- Cl2
- CO2
- XeF4
Bila sudah terbiasa maka dengan cepat dapat ditentukan.
CH4
C atom pusat (jumlahnya hanya 1 atom).
C mempunyai e-valensi 4
H atom luar dengan e-valensi 1
H merupakan atom monovalen (perlu 1 elektron lagi untuk stabil)
H berjumlah 4 atom → X4
Jumlah EB = valensi atom pusat – (jumlah atom luar × elektron yang diperlukan per atom)
Jumlah EB = 4 – (4 × 1) = 4 – 4 = 0
PEB = 0 → E0
CH4 → sistem AX4E0→ AX4E0 → bentuk molekul tetrahedral → nonpolar
HCl → molekul polar, molekul diatomik tetapi beda nilai keelektronegatifannya sehingga akan terjadi pengkutuban atau dipol, elektron tertarik ke atom yang memiliki keelektronegatifan lebih besar. Cl lebih elektronegatif dibanding H.
NH3→ Sama dengan AsH3 bahasan soal nomor 1, sebab N segolongan dengan As. NH3 bersifat polar.
C6H13NH2→ molekul polar, seperti pada NH3 memiliki 1 PEB pada N, berbentuk piramida segitiga, bentuk tidak simetri, C6H13 ini adalah pengganti 1 atom H pada NH3 .
NaCl → senyawa ionik, jelas tidak bersifat nonpolar.
CH3Cl → bentuk molekulnya seperti CH4, 1 atom H diganti atom Cl. Karena Cl memiliki keelektronegatifan berbeda dengan H maka sifat molekulnya polar.
H2S →
S atom pusat (jumlahnya hanya 1 atom).
S mempunyai e-valensi 6
H atom luar dengan e-valensi 1
H merupakan atom monovalen (perlu 1 elektron lagi untuk stabil)
H berjumlah 2 atom → X2
Jumlah EB = valensi atom pusat – (jumlah atom luar × elektron yang diperlukan per atom)
Jumlah EB = 6 – (2 × 1) = 6 – 2 = 4
PEB = jumlah EB/2 = 4/2 = 2 → E2
H2S → sistem AX2E2→ bentuk molekul bengkok → polar
Kr → atom golongan gas mulia → nonpolar.
Kesimpulan, dari pilihan molekul yang tersedia yang bersifat nonpolar adalah CH4 dan Kr. Jadi yang memiliki gaya dispersi adalah CH4 dan Kr.
a. 1,75 mol/kg
b. 1,87 mol/kg
c. 1,77 mol/kg
d. 1,85 mol/kg
e. 1,90 mol/kg
Jawaban : c
Basis perhitungan 1 L larutan fruktosa
Kemolalan laerutan fruktosa, m = n fruktosa / w air x 1.000
Diketahui, dalam 1 L larutan
– mol fruktosa, n Fruktosa = 1,476 mol
– menghitung massa air, w air = w larutan –w froktosa
Massa larutan
= ρ x V
= 1,1 g/Ml x 1000 ml
= 1100 g
Massa fruktosa = n fruktosa x Mm
= 1,476 mol x 180 g/mol
= 265,6 g
Diperoleh w air = w larutan – w fruktosa = 1100 g – 265,6 g = 834,4 g
Jadi, kemolalan larutan fruktosa
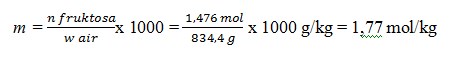
22. Jika didalam suatu larutan yang dibuat dengan melarutkan 4,5 gram glukosa (C6H12O6) dalam 100 gram air,kemolalanya adalah …. (Ar C = 12, H =1, O = 16)
a. 0,25 molal
b. 0,4 molal
c. 0,3 molal
d. 0,5 molal
e. 0,43 molal
Jawaban: a
Pembahasan
Mr C6H12O6 = 180
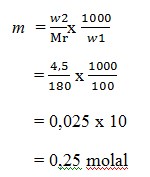












Tidak ada komentar:
Posting Komentar