Kuis 8. Buatlah 2 soal (per chapter) pilihan ganda dari tugas kelompok lain Chapter 13 s/d 18).
CHAPTER 13
1.Grafik yang menyatakan reaksi orde satu adalah ..
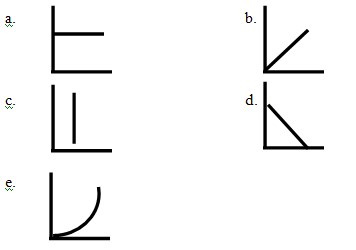
Jawaban : B
Pembahasan :
Persamaan laju dari reaksi aA → bB dapat dituliskan
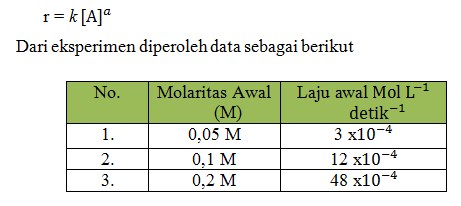
Tentukan orde reaksi!
a. 1
b. 2
c. 3
d. 4
e. 5
Pembahasan
Jika reaksi tersebut memiliki orde reaksi terhadap a = 1, maka laju reaksi sebanding dengan molaritas [A] , yaitu r = k[A]
Hal ini tidak mungkin, karena pada molaritas awal nomor 2 ketika molaritas awal dinaikan 2 kali, laju awal 4 kali lebih besar. Orde reaksi dapat dicari dengan cara membandingkan laju reaksi dari masing-masing.

Jawaban : B
CHAPTER 14
1.Perhatikan reaksi kesetimbangan berikut:
![]()
Apabila pada volume tetap pada temperatur dinaikkan, keserimbangan bergeser kearah…
a. Kanan dan harga K tetap
b. Kiri dan harga K kecil
c. Kanan dan harga K semakin besar
d. Kanan dan harga K semakin kecil
e. Kiri dan harga K makin besar
Pembahasan:
Kenaiakan temperatur menyebabkan kesetimbangan bergeser kekanan, kearah hasil dan harga K naik.
Jawaban : C
2. Diketahui reaksi :
2A(s) + B(l) → 3C(s) +2D(g)
Tentukan harga Kp
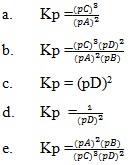
Pembahasan
Zat-zat pereaksi dipangkatkan koefisiennya akan mempunyai harga tetap. Jika reaksi itu dalam wujud solid dan liquid maka diabaikan.
Jawaban : C
CHAPTER 16
perhatikan tabel berikut ini.
| Larutan | Perubahan pH Setelah Ditambah | ||
| Air | Asam Kuat | Basa Kuat | |
| 1 | 2,48 | 2,32 | 13,45 |
| 2 | 2,32 | 1,70 | 13,01 |
| 3 | 4,73 | 4,66 | 12,52 |
| 4 | 4,75 | 4,76 | 4,76 |
| 5 | 4,75 | 1,45 | 12,55 |
Larutan yang memiliki sifat penyangga adalah ….
a. 1
b. 2
c. 3
d. 4
e. 5
Jawaban : D
Pembahasan :
Ciri-ciri larutan penyangga : saat ditambah sedikit air atau sedikit basa atau sedikit asam nilai pH relatif tetap, jika terjadi perubahan hanya relatif kecil.
Larutan yang paling mendekati perubahan pH setelah penambahan air, asam dan basa adalah larutan 4.
2. Ke dalam larutan basa lemah LOH ditambahkan padatan garam L2SO4 sehingga konsentrasi larutan LOH menjadi 0,1 M dan konsentrasi L2SO4 0,05 M. Bila Kb basa LOH = 10-5 maka pH campuran adalah…
a. 11
b. 9 + log 2
c. 9
d. 5
e. 5 – log 2
Jawaban : B
Pembahasan :
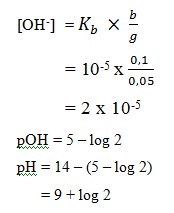
Chapter 17
1. 1,5 m3 gas helium yang bersuhu 27°C dipanaskan secara isobarik sampai 87°C. Jika tekanan gas helium 2 x 105 N/m2, gas helium melakukan usaha luar sebesar…
A. 60 kJ
B. 120 kJ
C. 280 kJ
D. 480 kJ
E. 660 kJ
Jawab: A
Pembahasan:
V1 = 1,5 m3
T1 = 27°C = 300 K
T2 = 87°C = 360 K
P = 2 x 105 N/m2
W = PΔV
Mencari V2 :
V2/T2 = V1/T1
V2 = ( V1/T1 ) x T2 = ( 1,5/300 ) x 360 = 1,8 m3
W = PΔV = 2 x 105 (1,8 − 1,5) = 0,6 x 105 = 60 x 103 = 60 kJ.
2. Mesin Carnot bekerja pada suhu tinggi 600 K, untuk menghasilkan kerja mekanik. Jika mesin menyerap kalor 600 J dengan suhu rendah 400 K, maka usaha yang dihasilkan adalah…
A. 120 J
B. 124 J
C. 135 J
D. 148 J
E. 200 J
Jawab: E
Pembahasan:
η = ( 1 − Tr / Tt ) x 100 %
Hilangkan saja 100% untuk memudahkan perhitungan :
η = ( 1 − 400/600) = 1/3
η = ( W / Q1 )
1/3 = W/600
W = 200 J
Chapter 18
1. Logam yang dapat mencegah korosi pada bumper mobil adalah …
a. Kromium
b. Timbal
c. Timah
d. Magnesium
e. Nikel
Jawaban : A
Pembahasan :
Untuk mencegah korosi pada bumper mobil, bumper mobil tersebut dilapisi oleh kromium.
Kromium dapat melindungi bumper mobil dari korosi. Kromium juga memberi kesan yang mengkilap pada bumper mobil. Proses pelapisan ini dinamakan Cromium Plating (pelapisan dengan kromium.
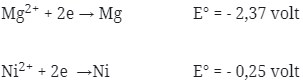
2.Potensial yang dihasilkan oleh reaksi Mg + NiCl2 → MgCl2 + Ni adalah …
a. -2,12 volt
b. +2,12 volt
c. +1,06 volt
d. -2,62 volt
e. +0,80 volt
Perhatikan E° nya ! logam yang memiliki E° lebih kecil selalu merupakan anode (mengalami oksidasi). Sudah pasti bahwa Mg adalah anode (mengalami oksidasi) dan Ni adalah Katode (mengalami reduksi).
Pada soal reaksi tidak berbentuk ion, berarti NiCl2 dan MgCl2 dipecah lagi sehingga menghasilkan ion.
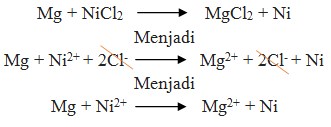
= – 0,25 – (- 2,37 )
= + 2,12 volt
- ubah pm ke cm dengan

- mengubah memberikan massa atom 235amu ke gram
- temukan massa jenis dengan membagi massa dengan volume

 melambangkan elektron dari orbital atom.
melambangkan elektron dari orbital atom. elektron bukan dari orbital atom
elektron bukan dari orbital atom melambangkan elektron bukan dari orbital atom.
melambangkan elektron bukan dari orbital atom. elektron dari orbital atom
elektron dari orbital atom
 melambangkan elektron dari orbital atom.
melambangkan elektron dari orbital atom.
 melambangkan elektron bukan dari orbital atom
melambangkan elektron bukan dari orbital atom



Tidak ada komentar:
Posting Komentar